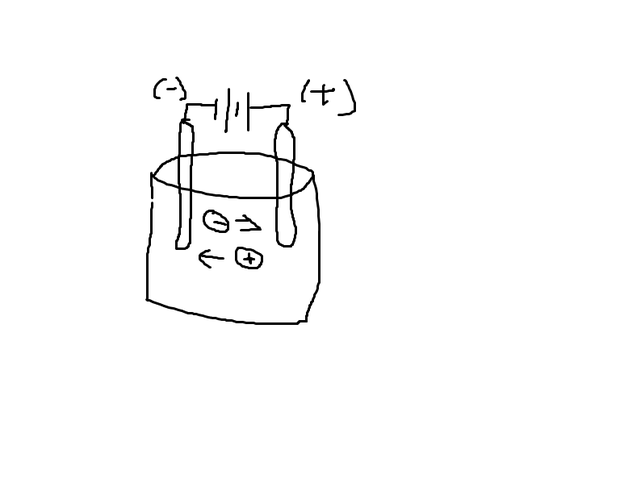
음이온이 +극으로가서 전자를 내놓고, 나온 전자가 도선을 타고 올라가 -극에 있는 양이온에게 전자를전달하고, 다시 전자를받은양이온이 +극으로 이동해서 전자를 주고... 쭉 반복된다
이게 맞는건가요?
그러면 궁금한점이 하나 있습니다.
전자는 -극에서 +극으로 흐르는걸로 아는데요.
만약 저말대로라면, 음이온에서 나온 전자가 +에서 -로 가는거아닌가요?
이게 어떻게가능한지??
원리가 틀린거라면 처음부터 알려주시길 부탁드립니다..
질문자 채택된 경우, 추가 답변 등록이 불가합니다.
1번째 답변

knite201님의 답변입니다.
- 채택답변수865
- 2016.02.25. 21:48
질문자 인사
정말 많은 도움 되었습니다. 나중에 또 질문해도 답변해 주실거죠?
그림으로 그리신 것이 맞습니다.
이온의 이동은 음이온이 (+)극으로 이동하여 전자를 내어놓고 중성의 원자(또는 분자)가 되고 양이온이 (-)극으로 이동하여 전자를 받아서 중성의 원자(또는 분자)가 됩니다.
그러므로 그림으로 그리신 것이 맞는 내용입니다.
아래쪽에 질문을 하신 전자의 이동은 (-)극 → (+)극 으로 이동하는 것은 전류가 흐르기 위해서 도선(전선)에서 이동되는 방향입니다.
자세한 내용은 나름 어려운 내용이기는 합니다.(고등학교에서 나옵니다)
대략적인 설명을 하자면 이온의 이동에서 음이온이 (+)전극, 양이온이 (-)전극으로 이동을 하는 것은 산화-환원 반응으로 설명을 하여야 합니다.
물론 중 3 내용에 산화-환원에 대한 부분이 나오기는 하지만 산소(O)에 대한 부분으로 따지는 산화-화원 개념으로 전자에 대한 부분이 아니라 이해가 어려울 수 있습니다.
산화-환원 반응은 3가지로 구분을 할 수 있습니다.
1. 산소의 결합, 해리(분리)에 대한 산화-환원반응 → 중등과정
2. 전자의 이동에 의한 산화-환원반응 → 고등과정
3. 산화수 변화에 대한 산화-환원바응 → 고등과정
또한 도선에서 전자의 이동과 전해질 수용액에서의 전자의 이동(전극으로의 이동)부분은 내용이 조금 다릅니다.
설명이 장황해지고 어려운 내용이므로 쪽지를 주시면 설명을 드리겠습니다.
결론적으로 말씀드리자면 그림의 내용은 정확하게 그리신 것입니다.
또한, 전해질 수용액에서의 이온의 이동은 전극의 개념으로 이해하시면 안됩니다.
이온의 이동은 음이온이 (+)극으로 이동하여 전자를 내어놓고 중성의 원자(또는 분자)가 되고 양이온이 (-)극으로 이동하여 전자를 받아서 중성의 원자(또는 분자)가 됩니다.
그러므로 그림으로 그리신 것이 맞는 내용입니다.
아래쪽에 질문을 하신 전자의 이동은 (-)극 → (+)극 으로 이동하는 것은 전류가 흐르기 위해서 도선(전선)에서 이동되는 방향입니다.
자세한 내용은 나름 어려운 내용이기는 합니다.(고등학교에서 나옵니다)
대략적인 설명을 하자면 이온의 이동에서 음이온이 (+)전극, 양이온이 (-)전극으로 이동을 하는 것은 산화-환원 반응으로 설명을 하여야 합니다.
물론 중 3 내용에 산화-환원에 대한 부분이 나오기는 하지만 산소(O)에 대한 부분으로 따지는 산화-화원 개념으로 전자에 대한 부분이 아니라 이해가 어려울 수 있습니다.
산화-환원 반응은 3가지로 구분을 할 수 있습니다.
1. 산소의 결합, 해리(분리)에 대한 산화-환원반응 → 중등과정
2. 전자의 이동에 의한 산화-환원반응 → 고등과정
3. 산화수 변화에 대한 산화-환원바응 → 고등과정
또한 도선에서 전자의 이동과 전해질 수용액에서의 전자의 이동(전극으로의 이동)부분은 내용이 조금 다릅니다.
설명이 장황해지고 어려운 내용이므로 쪽지를 주시면 설명을 드리겠습니다.
결론적으로 말씀드리자면 그림의 내용은 정확하게 그리신 것입니다.
또한, 전해질 수용액에서의 이온의 이동은 전극의 개념으로 이해하시면 안됩니다.
No comments:
Post a Comment